유전자 치료제, ‘꿈의 新藥시대’ 연다.
기적같은 일들이 일어난다. 심장에 ‘VEGF’ 라는 유전자를 주입 받고 건강을 되찾게 된다. 이처럼 난치·불치병들이 ‘유전자 치료’를 통해 극복되는 사례가 늘어난다. 인간의 ‘유전자’를 ‘약’으로 사용하는 ‘유전자 치료제’는 21세기의 떠오르는 첨단신약으로 주목 받고 있다. 유전자 치료제는 질병의 원인을 유전자 차원에서 분석, 치료 유전자 또는 유전자를 집어넣은 세포를 인체에 투여해 근본적인 치료를 하기 때문에 막강한 위력을 발휘할 것으로 기대되고 있다.
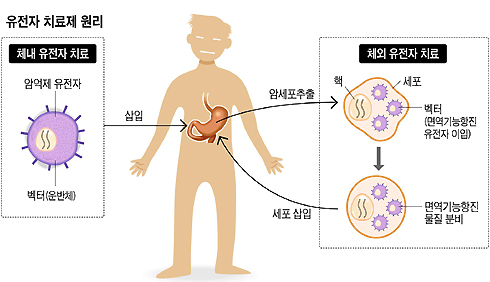
■ 유전자 치료제, 어떻게 작용하나?
유전자 치료는 투여 방법에 따라 체외(體外) 치료제, 체내(體內) 치료제로 나뉜다. '체외 치료제'는 환자의 조직으로부터 세포를 추출한 뒤 이 세포에 유전적인 변형을 가해 이를 다시 환자의 체내에 투입하는 방식이다. 치료해야 할 목적 세포에 대한 선별 공략이 가능하다는 이점이 있지만 환자 세포의 특성에 따라 치료 결과가 달라질 수 있고, 세포 조작을 해야 하니 비용도 들고 품질관리도 어렵다.
반면, '체내 치료제'는 환자의 몸에 필요한 유전자를 직접 주입하는 방식이다. 환자에 따른 특이성이 비교적 적고, 비용도 절약될 수 있지만 유전자 전달 효율, 발현량, 안전성 등에 문제가 생길 수 있다는 게 단점이다.
'종양 억제 치료제'는 유전자 치료제 중 첫번째로 발매됐다. 간암, 전립선암, 폐암, 유방암, 두경부암, 난소암 등의 암 질환 유전자 치료의 가능성이 타진되고 있고, 적용 범위가 확대돼 가고 있다.
'심혈관질환 유전자 치료제'는 관상동맥질환(허혈성 심질환)이나 말초동맥질환(허혈성 지체질환)처럼 동맥경화 등의 원인 때문에 혈관이 좁아지거나 막혀서 발생하는 질환을 대상으로 한다. 혈관 신생 유전자를 사용해, 혈관의 생성을 유도하고 혈류를 회복하게 하는 원리이다.
이외에도 알츠하이머 치매, 헌팅톤병, 파킨슨병, 뇌졸중, 뇌척수손상, 신경근육계 질환 등 '뇌신경질환 유전자 치료제'가 있다. 다른 치료제에 비해 개발은 늦은 편이지만 최근 원인 유전자를 규명하는 연구가 속도를 내고 있다.
■ 유전자 치료제가 ‘맞춤 의료시대’ 연다.
전 세계적으로 유전자 치료제 임상시험은 2007년 1월 기준 1280여 건이 진행되고 있으며, 대부분 미국(65%), 유럽(28%)에서 진행되고, 아시아에서 이뤄지는 임상시험은 3%에 그친다. 현재 200개 이상의 회사에서 개발하고 있는 유전자 치료제 중 임상시험의 마지막 단계에 진입한 것이 약 30건으로 이들 제품이 봇물처럼 쏟아질 날이 멀지 않았다. 지금도 중국에서 2건의 유전자 치료제가 시판되고 있고, 지난 4월 유럽에서도 유전자 치료제 생산이 허가됐다. 국내에서는 모두 8개의 유전자 치료제가 임상시험 중이다.
국내의 경우, 짧은 연구 개발 역사에도 불구하고, 유전자 전달체 관련 기술이 세계적인 수준에 이르렀다. 최근에는 치료 유전자 발굴 성과도 잇따르고 있어, 명실상부하게 세계적인 경쟁력을 확보한 유전자 치료제가 개발될 가능성도 엿보인다. 질병치료와 관련된 적절한 치료 유전자를 확보해 기술력을 선점하고, 생명과학 정보들을 효율적으로 선별, 활용한다면 개인별 맞춤의료 세상을 우리가 먼저 열 수도 있을 것이다.
의약품시장 예측기관들은 세계 유전자 치료제 시장이 향후 2~3년 내 본격적으로 확대되고, 연평균 100% 이상의 고(高)성장을 거듭할 것으로 전망한다. 2010년 무렵, 수십억 달러 규모의 시장이 형성될 것이라는 얘기다.
■ 유전자 치료제, 안전하고 효과적인가?
유전자 치료제의 앞길에는 아직 난관이 많다. 가장 큰 문제는 안전성이다. 유전자를 인체에 투여하기 위해 지금까지는 아데노 바이러스에 유전자를 실어 보냈는데, 이 바이러스는 인체에 침투하는 데에는 효과적이지만 독성이나 면역반응의 부작용이 동반된다는 문제점이 있다.
이런 문제점을 잘 보여주는 사례가 1999년 9월 미국 펜실베이니아 대학에서 있었다. 당시 18세의 건장한 남자 제시 겔싱어(Jessie Gelsinger)는 유전병인 ‘OTC(ornithine transcarboxylase) 결핍증’(신체에 암모니아를 증가시키는 질병)을 앓고 있었는데, 이 병을 치료하기 위해 유전자 치료 임상시험에 자원해 치료를 받다가 불과 나흘만에 호흡곤란으로 사망했다. 유전자를 실어보내기 위해 사용한 아데노 바이러스를 과다 사용해 염증이 발생했기 때문인 것으로 추정됐다.
2002년 프랑스에서는 일명 ‘버블보이 병’이라 불리는 희귀한 중증면역결핍증(X-SCID)을 앓고 있는 일곱 명의 소아에게 유전자 치료를 수행했는데, 그 중 2명에게서 백혈병이 발병했다. 원인은 환자에게 주입된 유전자가 염색체의 목표했던 특정 위치에 삽입되지 못한 데서 생긴 것으로 추정되고 있다.
이 때문에 우리나라는 유전자 치료제를 ‘유전성 질환, 암, 에이즈(AIDS) 및 기타 생명을 위협하거나 심각한 장애를 초래하는 질환’과 ‘현재 이용 가능한 치료법이 없거나 유전자 치료제의 효과가 현재 이용 가능한 다른 치료법과 비교하여 우수함을 예측할 수 있는 경우’로 제한하고 있다. (조선일보, 최윤정 KiSTi 선임연구원, 입력: 2007.05.11)
'건강 (Bio 혁명)' 카테고리의 다른 글
| 혈액 검사 및 질병 진단 ‘로봇’ 개발 (0) | 2008.07.07 |
|---|---|
| 질병 진단. 치료용 나노캡슐 개발 (0) | 2008.02.18 |
| 늙지 않고 죽지 않는 신인류 시대 온다! (0) | 2007.01.01 |
| 초음파로 치아(齒牙) 조직 재생 성공 (0) | 2006.07.17 |
| 암부터 관절염까지" 만병통치 '슈퍼약' 개발 (0) | 2006.07.17 |